4.ÜNİTE SAF MADDE VE KARIŞIMLAR
1. BÖLÜM MADDENİN TANECİKLİ YAPISI
1.1 Atomun Yapısı
Doğadaki tüm maddeler gözle görülemeyecek boyutta yapı taşlarından oluşur. Bu yapı taşları atom adını alır.
Atomlar bir araya gelerek nesneleri ve etrafımızdaki diğer malzemeleri oluşturur. Günlük yaşantımızda kullandığımız tüm araç gereçler, hatta vücudumuz bile atomlardan oluşur.
Atomun temel parçacıkları vardır. Bunlar: Proton, nötron ve elektronlardır
Proton ve nötron atomun yapısındaki çekirdek adı verilen kısımda yer alır. Elektronlar ise çekirdeğin etrafındaki belli bölgelerde dolanır.
Bu bölgeler katman olarak adlandırılır.
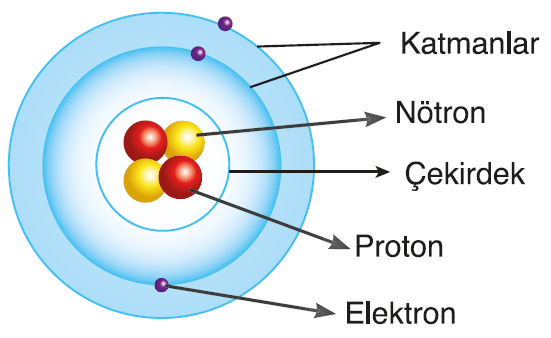
Elektronlar, çekirdeğin etrafında katman adı verilen belirli bölgelerde dolanır. Gerçekte böyle katmanlar bulunmazken katman kavramı atom modelini anlamayı kolaylaştırır.
Proton ve nötronların kütlesi, elektronların kütlesinden fazla olduğundan atomun kütlesinin büyük kısmını çekirdek oluşturur. Atomun hacminin büyük kısmını ise elektronlar oluşturur.

1.2 Geçmişten Günümüze Atom Kavramı
Teori, geçerlilik ve güvenirliliği bilimsel yöntemle saptanmış genel bilgi ve açıklamalardır. Günümüzde geçmişte öne sürülen teorilerin
bazıları kabul edilirken bazıları geçerliliğini yitirmiştir.Atomla ilgili teorilerden bazıları aşağıda verilmiştir.
Atom hakkında ilk görüş MÖ 400’lü yıllarda Yunanlı filozof Democritus tarafından ortaya konmuştur. Democritus, maddenin taneciklerden oluştuğunu savunmuş ve bu taneciklere “atom” adını vermiştir. Democritus, atom hakkındaki görüşlerini deneylere değil varsayımlara göre söylemiştir.

Atom hakkında ilk bilimsel görüş İngiliz bilim insanı John Dalton tarafından ortaya atılmıştır. Dalton ’a göre maddenin en küçük yapı taşı atomdur ve atom içi dolu küre şeklindedir.
Bütün maddeler farklı tür atomlardan oluşmuştur.


Atomun yapısı hakkında ilk model 1897 yılında Thomson tarafından ortaya konmuştur. Thomson ’ın atom modeli bir üzümlü keke benzer. Thomson ’a göre atom küre şeklindedir ve atomda “+” ve “–” yüklü tanecikler bulunur. Atom, dışı tamamen pozitif yüklü bir küre olup negatif yüklü olan elektronlar kek içerisindeki üzümler gibi bu küre içerisine dağılmıştır.
Atomlar, daha küçük taneciklerden oluştuğu için parçalanabilir.


Atomun çekirdeğini ve çekirdekle ilgili birçok özelliği ilk keşfeden bilim insanı Rutherford’dur. Elektronlar çekirdek etrafında gezegenlerin Güneş etrafında dolandığı gibi dairesel yörüngelerde sürekli dolanırlar. Rutherford’a göre çekirdekle elektronlar arasında çekim kuvveti olduğundan elektronların çekirdeğe düşmemeleri için belli yörüngelerde dolanmaları gerekir (Bu yörünge daire şeklinde değil, enerji seviyesine karşılık gelen katmanlardır).

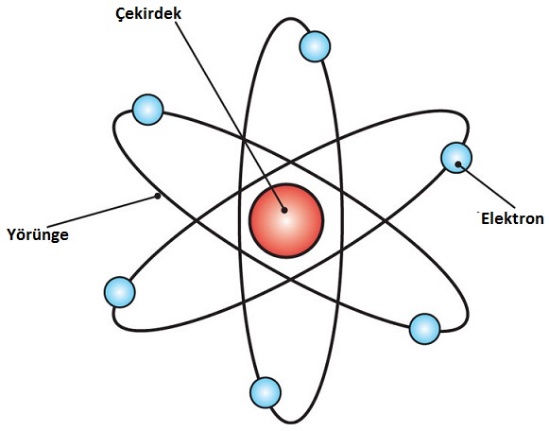
Bohr’a göre; elektronlar çekirdek etrafında belirli uzaklıklardaki katmanlarda dönerler, rastgele dolanmazlar.
Geliştirdiği yeni atom modeliyle 1922 yılında Nobel Fizik Ödülünü kazanan Niels Bohr, yaşamının sonuna kadar bilime hizmet etmeyi sürdürmüştür.

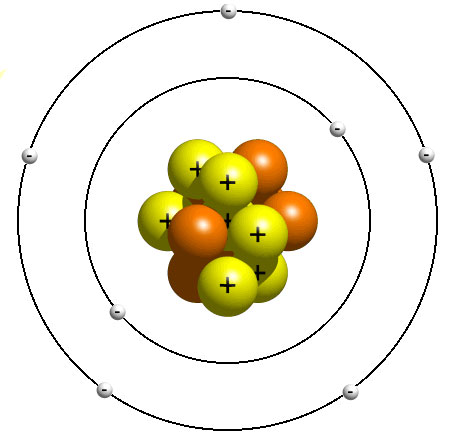
Modern Atom Teorisi
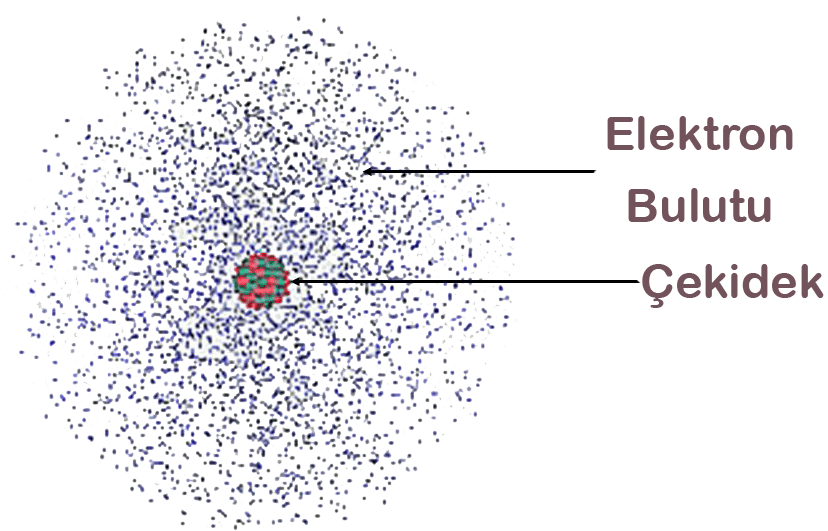
Günümüzde geçerliliğini koruyan atom görüşüdür. Bu teori’ye göre, elektronlar çok hızlı hareket ettikleri için katmanların yerine, elektronların bulunma ihtimalinin yüksek olduğu elektron bulutlarında yer aldığı savunulmuştur.
Atomlar bir araya gelerek molekül adı verilen yapıları oluşturur. Bir molekül aynı atomların bir araya gelmesiyle oluşabileceği gibi farklı atomların bir araya gelmesiyle de oluşabilir.
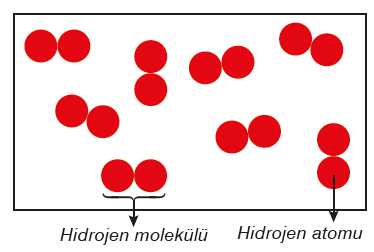
Aynı elementlerin atomlarından oluşan moleküller element molekulu olarak adlandırılır.
Element molekülleri tek çeşit atom içerir. Oksijen ve hidrojen doğada moleküller hâlinde bulunan elementlere örnektir.
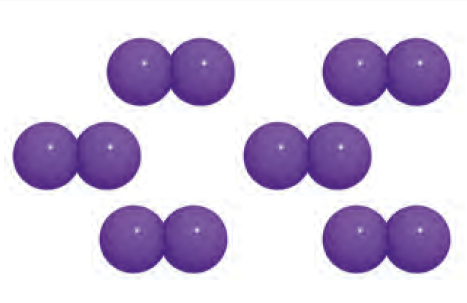
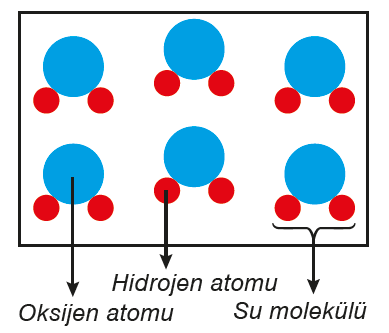
Farklı atomlardan oluşan moleküllerde ise atomların büyüklüğü ve özellikleri farklıdır.
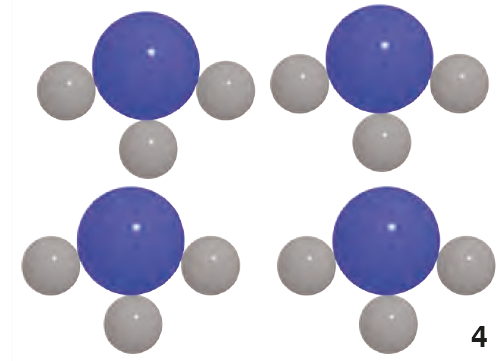
Bu şekildeki moleküller ise bileşik molekulu olarak adlandırılır. Su, şeker gibi bileşikler molekül yapılı bileşiklere örnektir.
2. BÖLÜM SAF MADDELER
2.1 Saf Maddeler
Fiziksel yollarla kendisinden başka maddelere ayrışmayan maddelere saf maddeler denir.
Yemeğinize attığınız tuz, çayınızdaki şeker, içtiğiniz su birer saf maddedir. Altın, demir, gümüş, bakır da birer saf maddedir. Saf maddeler, element ve bileşik olmak üzere iki grupta sınıflandırılır.
Bir madde hangi büyüklükte olursa olsun atomlardan oluşmuştur. Aynı cins atomlardan oluşan saf maddelere element denir. Bir elementin bütün atomları aynı iken farklı elementlerin atomları birbirinden farklıdır. Bu yüzden elementlerin her biri farklı özelliklere sahiptir. Elementler sembollerle gösterilir.
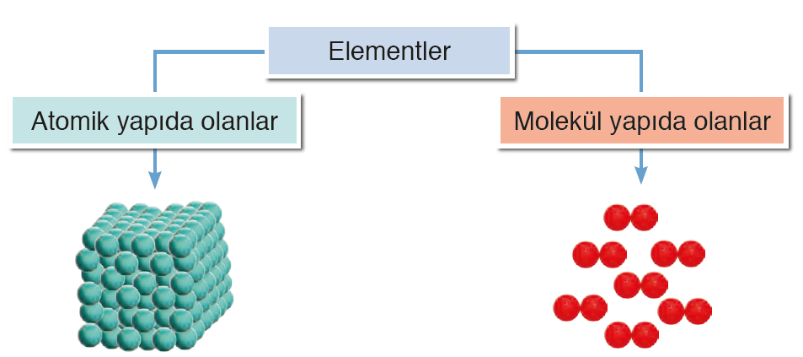
Elementler, atomik ve moleküler yapılı olmak üzere iki çeşittir. Aynı cins atomların doğada tek başlarına bulunmasıyla atomik, tek tek bulunamayıp gruplar hâlinde bulunmasıyla da moleküler yapılı elementler meydana gelir.
2.2 Elementlerin Sembolleri
Elementlerin sembolleri belirlenirken elementlerin Latince isimlerinin ilk harfi verilir. Ancak elementlerin ilk harfleri aynı olduğunda semboller ilk iki ya da üç harf ile gösterilir. Sembol tek harfli ise büyük harfle yazılır. Sembol iki ya da üç harf ile gösterilirse ilk harf daima büyük, diğerleri küçük yazılır.
Aşağıda bazı elementlerin isimleri, sembolleri ve kullanım alanları verilmiştir.
| Elementin Numarası | Elementin Adı | Sembol | Kullanım Alanı |
| 1 | Hidrojen | H | Roket yakıtı olarak kullanılır. Ayrıca suyun yapısında bulunur. |
| 2 | Helyum | He | Zeplin ve balon şişirmede kullanılır. |
| 3 | Lityum | Li | İlaçlarda, pil üretiminde, cam ve seramik yapımında kullanılır. |
| 4 | Berilyum | Be | Uçak ve uzay araçları yapımında elektrik ve ısı iletkeni olarak kullanılır. |
| 5 | Bor | B | Isıya dayanıklı cam yapımında ve roket yakıtında kullanılır. |
| 6 | Karbon | C | Kömür, petrol ve doğal gaz yapısında bulunur. |
| 7 | Azot | N | Tarımda gübre yapımında kullanılır. |
| 8 | Oksijen | O | Dalgıçlarda ve astronotlarda solunum için oksijen tüplerinde kullanılır. |
| 9 | Flor | F | Diş macununun yapısında kullanılır. |
| 10 | Neon | Ne | Renkli reklam panolarında kullanılır. |
| 11 | Sodyum | Na | Kâğıt, gıda, tekstil ve sabunda kullanılır. |
| 12 | Magnezyum | Mg | Hava taşıtlarının yapısında kullanılır. |
| 13 | Alüminyum | Al | Mutfak araç gereçlerinde, elektrikli araçlarda ve içecek kutularında kullanılır. |
| 14 | Silisyum | Si | Camın yapısında kullanılır. |
| 15 | Fosfor | P | Suni gübre yapımında kullanılır. |
| 16 | Kükürt | S | Barut yapımında kullanılır. |
| 17 | Klor | Cl | İçme sularını dezenfekte etmek için kullanılır. |
| 18 | Argon | Ar | Ampullerde ve floresan lambalarda kullanılır. |
Gunluk hayatta cokca bulunan diğer elementlerin adları, sembolleri ve bazı kullanım alanları şunlardır:
| Adı | Sembolü | Elementin Bazı Kullanım Alanları |
| Demir | Fe | İnşaat malzemesi olarak kullanılır. |
| Bakır | Cu | Süs eşyası yapımında kullanılır. |
| Altın | Au | Ziynet eşyalarının yapımında kullanılır. |
| Adı | Sembolü | Elementin Bazı Kullanım Alanları |
| Civa | Hg | Termometrelerin haznesinde civa elementi kullanılır. |
| Platin | Pt | Diş hekimliğinde, laboratuvar aletlerinde kullanılır. Oksit- lenmemesi nedeniyle tıpta ortopedi alanında kullanılır. |
| Kurşun | Pb | Akü imalatında kullanılır. |
| Çinko | Zn | Mutfak eşyası ve pil yapımında kullanılır. |
| Gümüş | Ag | Ziynet eşyalarının yapımında kullanılır. |
| İyot | I | Deniz ürünlerinde ve iyotlu sofra tuzlarında kullanılır. |
| Kalsiyum | Ca | Kemik ve dişlerin yapısında bulunur. |
2.3 Bileşik Formülleri
Farklı cins atomların bir araya gelerek oluşturdukları saf maddelere bileşik adı verilir. Doğada pek çok bileşik vardır. Yemeklere konulan tuz, çaya atılan şeker, temizlikte kullanılan sabun, temel yaşam kaynağımız olan su, bileşiklere örnek olarak verilebilir.
Bileşikler, moleküler ve atomik yapıda olanlar olmak üzere iki kısımda incelenir.
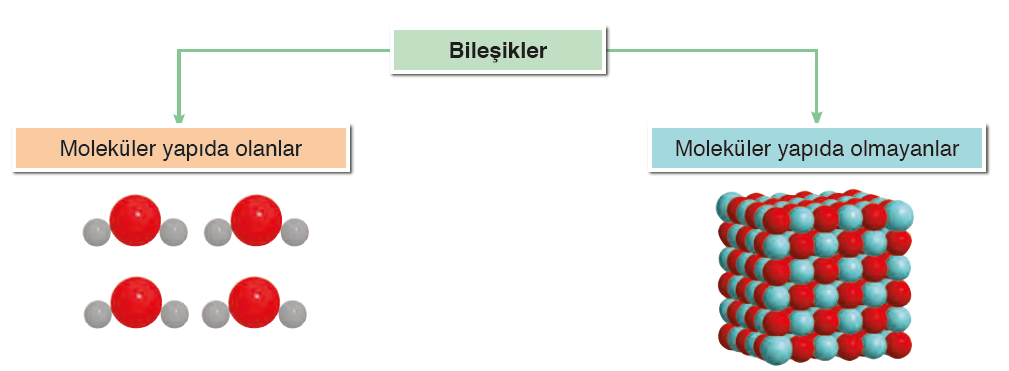
Bileşikler kimyasal yollarla kendini oluşturan elementlere ayrılabilir. Bileşikler formüllerle gösterilir. Bileşik formüllerinde bileşiği oluşturan elementlerin sembolleri yer alır.
Aşağıdaki tabloda bileşiklerin adı, formülü, molekül modeli ve kullanım alanları verilmiştir
| Bileşiğin İsmi | Bileşiğin Formülü | Bileşiğin Bazı Kullanım Alanları |
| Su | H₂O | Su bütün canlıların temel ihtiyacıdır. Yediğimiz besinle- rin sindirilmesine yardımcı olur. Vücuttaki atık madde- lerin dışarı atılmasında önemli rol oynar. |
| Amonyak | NH₃ | Boya, gübre, deterjan yapımında kullanılır. |
| Karbondioksit | CO₂ | Yangın söndürme tüplerinde ve gazlı içecek yapımında kullanılır. |
| Sodyum klorür | NaCl | Beyaz, kristal yapılı bir bileşiktir. Yemek tuzu olarak kullanılır. Gıdaların korunmasında, kışın yollarda olu- şan buzları eritilmesinde, kimya endüstrisinde, tıp ve eczacılıkta kullanılır. |
| Hidrojen klorür | HCI | Halk arasında tuz ruhu olarak bilinir. Temizlik malzeme- si olarak kulanılır. |
| Nitrik asit | HNO3 | Halk arasında kezzap olarak bilinir. Gübre endüstrisin- de kullanılır. |
3. BÖLÜM KARIŞIMLAR
3.1 Karışımlar
Birden fazla maddenin kimyasal özellikleri değişmeyecek şekilde istenilen oranda bir araya getirilmesi ile oluşan madde topluluğuna karışım denir.
Karışımlar görünümlerine göre homojen ve heterojen karışım olmak üzere ikiye ayrılır.
Özellikleri her yerinde aynı olan ve dışarıdan bakıldığında tek bir madde gibi görünen karışımlara homojen karışımlar denir.
Bu karışımlara aynı zamanda çözelti de denilmektedir. Deniz suyu, şekerli su, tuzlu su, parfüm, homojen karışımlara örnektir.
 |  |
| Deniz suyu | Şekerli su |
Özellikleri her yerinde aynı olmayan ve dışarıdan bakıldığında tek bir madde gibi görünmeyen karışımlara heterojen karışımlar denir. Süt, çorba, su-zeytinyağı, toprak gibi karışımlar heterojen karışımlardır.

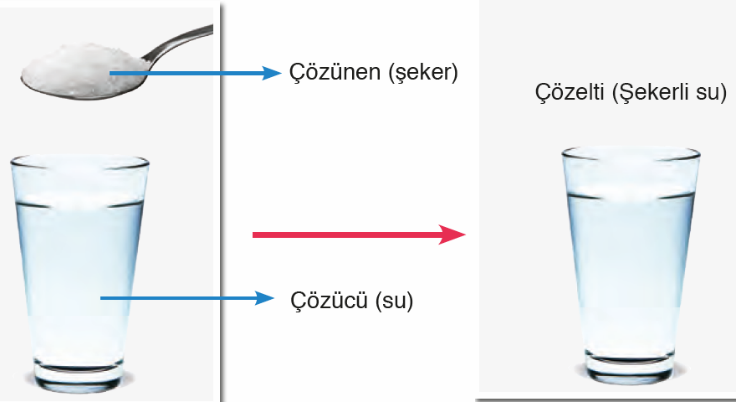
Çözelti, çözücü ve çözünenden oluşur. Maddelerin atom, iyon veya molekül büyüklüğünde dağıldığı ortama çözücü; atom, iyon veya molekül büyüklüğünde dağılan maddeye de çözünen denir.
Tuzlu su örneğinde su çözücü, tuz çözünendir. Çözelti oluşurken çözücü ve çözünen maddeler birbiri içerisinde dağılır. Dağılma, çözücünün taneciklerinin çözünenin taneciklerini birbirinden tek tek ayırması ve etrafını sarmasıyla gerçekleşir. Bu olaya çözünme denir.
Bir çözeltide miktarı çok olan maddeye çözücü, az olan maddeye ise çözünen adı verilir. Ancak sulu çözeltilerde miktarı az olsa bile su, çözücü olarak kabul edilir.
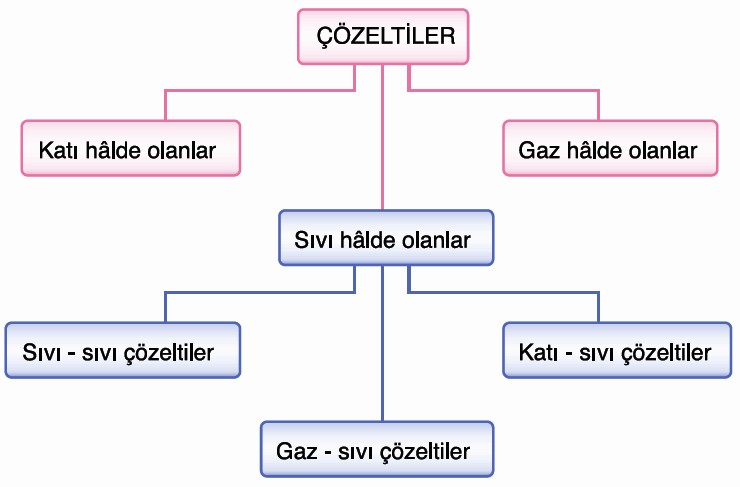
Katı çözeltiler genellikle en az bir metal içerir. Örneğin çelik, az miktarda karbonun demir içerisinde çözünmesiyle elde edilir. Metal içeren katı çözeltiler alaşım olarak adlandırılır. Alaşımlar metallerin eritilerek sıvı hâle getirilmesiyle oluşturulan karışımlardır.

Alaşım örnekleri
Gaz çözeltiler iki ya da daha fazla gazın homojen olarak karışmasıyla oluşur. Örneğin soluduğumuz hava, %78 azot ve %21 oksijen gazı içeren bir çözeltidir. Dolayısıyla bu çözeltide çözücü azot gazı, çözünen ise oksijen gazıdır.

Katı – Sıvı Çözeltiler: Bir katının sıvı içinde oluşturduğu homojen karışımlardır. Tuzlu su ve şekerli su, katı – sıvı çözeltilere örnektir.
Sıvı – Sıvı Çözeltiler: Bir sıvının başka bir sıvı içinde oluşturduğu homojen karışımlardır. Sirke ve kolonya, sıvı – sıvı çözeltilere örnektir.
Gaz – Sıvı Çözeltiler: Bir gazın sıvı içinde oluşturduğu homojen karışımlardır. Gazoz, gaz – sıvı çözeltilere örnektir.
 |  |  |
| Katı – Sıvı Çözeltiler | Sıvı – Sıvı Çözeltiler | Gaz – Sıvı Çözeltiler |
Çözünme hızını etkileyen faktörler:
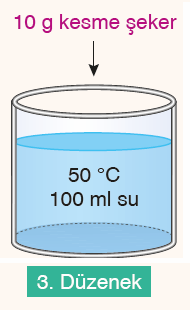
1-Sıcaklık: Sıcaklık arttıkça moleküller daha hızlı hareket eder ve çözünen ile çözücü molekülleri daha kısa sürede etkileşir yani sıcaklık yükseldikçe çözünme hızlanır.
2- Tanecik Boyutu: Tane boyutu küçüldükçe çözünen maddenin çözücü ile temas yüzeyi artar. Bu da çözünmenin hızlanmasını sağlar. Etkinlikte de gözlemlediğiniz gibi aynı sıcaklıkta eşit miktardaki sulara toz şeker ve kesme şeker atıldığında toz şekerin daha çabuk çözünmesinin nedeni temas yüzeyinin fazla olmasıdır.
3- Karıştırma: Çözeltiyi karıştırmak çözünme hızını artırır. Bir deney yapılırken belli değerler sabit tutularak diğerleri kontrol edilir. Deney sırasında değiştirilen değişkenlere bağımsız değişken denir. Bağımsız değişkenlere bağlı olarak değişen değişkenlere bağımlı değişken adı verilir. Miktarı değişmeyen değişkenlere ise kontrol edilen veya sabit tutulan değişken adı verilir.
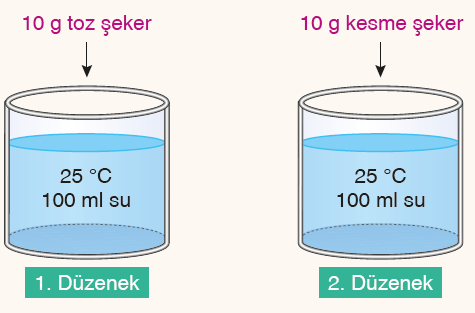
| 1. ve 2. düzenekler | |||
| Bağımsız değişken | Bağımlı değişken | Kontrol edilen değişken | |
| Tanecik boyutu | Çözünme süresi (hızı) | Sıcaklık, sıvı cinsi ve miktarı | |
| 2. ve 3. düzenekler | |||
| Bağımsız değişken | Bağımlı değişken | Kontrol edilen değişken | |
| Sıcaklık | Çözünme süresi (hızı) | Tanecik miktarı ve boyutu, sıvı cinsi ve miktarı | |
4. BÖLÜM KARIŞIMLARIN AYRILMASI
4.1 Karışımların Ayrılması
Karışımlar fiziksel yöntemlerle oluşur ve basit fiziksel yöntemlerle kendini oluşturan maddelere ayrılabilir.
Karışımlar ayrılırken karışımı oluşturan maddelerin türüne, fiziksel hâline ve karışımın çeşidine göre farklı yöntemler kullanılır.
1.Süzme Yöntemi
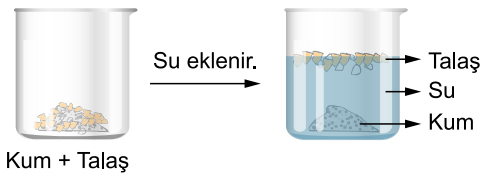
Birbiri içinde çözünmeyen Katı sıvı karışımlarını ayırmak için kullanılır. Süzme işleminde katı tanecikleri geçirmeyen süzgeçler kullanılır. Çay süzgeci, Makarna süzgeci örnek verilebilir. Örnek: Kum Su, Su Talaş vb.


2.Eleme Yöntemi
Değişik irilikteki katı taneciklerden oluşan karışımları birbirinden ayırmak için eleme yöntemi kullanılır. Çakıl-kum, kepek-un, kömür-kömür tozu bu yöntemle birbirlerinden ayrılır.

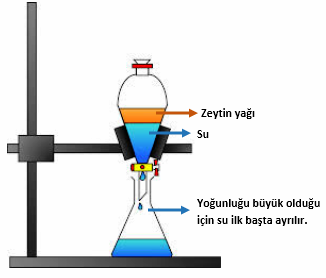
3. Ayırma hunisi ile ayırma yöntemi:
Birbiri içinde çözünmeyen sıvı-sıvı heterojen karışımları ayırmak için kullanılır. Sıvı-sıvı heterojen karışım ayırma hunisine konulur. Belirli biri süre sonra yoğunluğu fazla olan sıvı huninin altında birikir. Huninin musluğu açılarak alttaki sıvı başka bir kaba alınır. Böylece iki sıvı birbirinden ayrılmış olur.
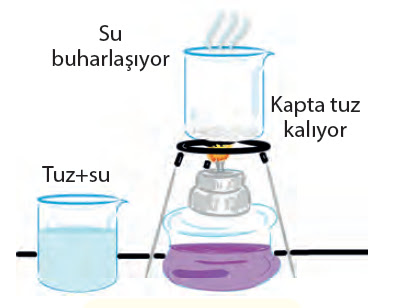
4. Buharlaştırma yöntemi
Genellikle katı-sıvı homojen karışımları birbirinden ayırmak için kullanılır.
Tuzlu su, şekerli su, tentürdiyot süt gibi karışımlar bu yöntemle kendisini oluşturan maddelere ayrılabilir.
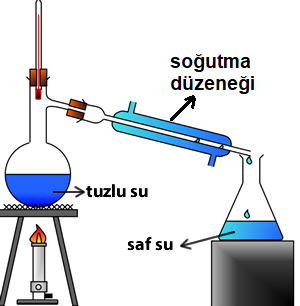
5. Damıtma Yöntemi
Birbiri içinde çözünen sıvı-sıvı homojen karışımları ayırmak için kullanılır. Bu yöntemde maddelerin kaynama noktaları farkından yararlanılır.
Karışım damıtma kabına konulup ısıtılır kaynama noktası düşük olan sıvı kaynar ve buharlaşır buharlaşan sıvı cam tüplerden geçerken soğutularak tekrar sıvı hale geçer ve başka bir kaba alınır böylece damıtma işlemi tamamlanarak iki sıvı birbirinden ayrılır.
6.Mıknatısla ayırma yöntemi:
Demir, Nikel ve Kobalt gibi maddeler mıknatıslar tarafından çekilir. Karışımı oluşturan maddelerden biri mıknatıs tarafından çekilme özelliğine sahipse bu yöntemle ayrılabilir.

7. Yüzdürme yöntemi
Sıvılarda çözünmeyen katı maddeleri ayırmak için kullanıldığı gibi katı katı karışımları ayırmak içinde kullanılabilir. Yani Katı katı karışımı suya atılır, yoğunluğu büyük olan dibe batar küçük olan ise su da yüzer. Su da yüzen ayıklanarak alınır sonra süzme yöntemi ile diğer katı sudan ayrılarak işlem tamamlanır.
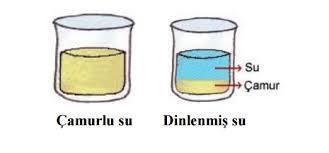
8. Dinlendirme yöntemi:
Bir sıvı ve içine dağılmış katı tanecikleri dibe çöktürülerek birbirinden ayrılması, dinlendirme yöntemiyle yapılır
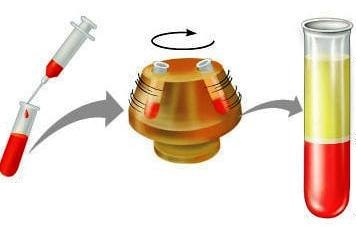
Santrifüj cihazları kullanılarak çöktürme yöntemiyle kanın sıvı kısmı ve hücreler ayrılabilir. Bu yöntem hastalıkların teşhisinde kolaylık sağlar.
5. BÖLÜM EVSEL ATIKLAR VE GERİ DÖNÜŞÜM
5.1 Evsel Atıklar ve Geri Dönüşüm
İnsanların sosyal ve ekonomik faaliyetleri sonucunda işe yaramaz hâle gelen, kullanım süresi dolmuş maddelere atık denir.

Meyve suyu, süt, su gibi içeceklerin şişeleri; plastik deterjan kutuları veya poşetler; kırılan cam eşyalar ya da bozulan plastik eşyalar evsel katı atıklardır. Ayrıca kullanılamaz hâlde olan televizyon, telefon, bilgisayar gibi elektronik araçlar ve bitmiş piller de evsel birer katı atıktır. Kızartma yapıldıktan sonra yanmış olan yağlar ise evsel sıvı atıklardandır.
 |  |
| evsel katı atıklar | evsel sıvı atıklar |
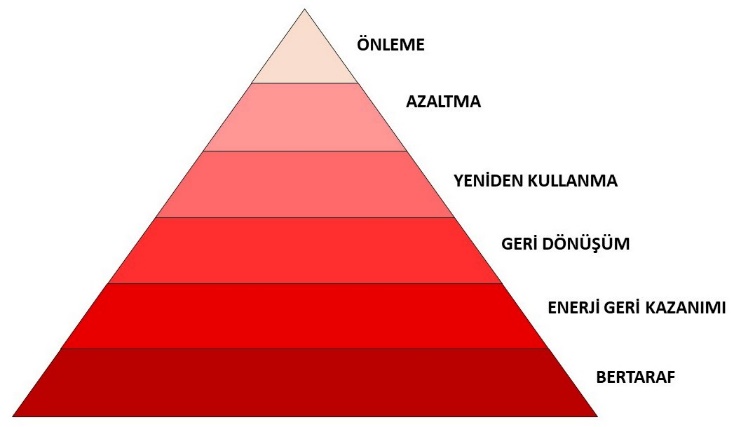
Geri donuşum yeniden değerlendirilme imkânı olan atıkların çeşitli işlemlerden geçirilerek ham maddeye dönüştürülmesi ve tekrar üretim sürecine dâhil edilmesidir. Yeniden kullanım ise atıkların toplama ve temizleme dışında hiçbir işleme tabi tutulmadan aynı şekli ile ekonomik ömrü dolana kadar defalarca kullanılmasıdır.
Geri dönüşümde amaç kaynakların lüzumsuz kullanılmasını önlemek ve atıkların kaynağında ayrılarak atık miktarının azaltılması olarak düşünülmelidir.


Geri Donuşumun Onemi
* Doğal kaynakların korunmasını sağlar.
* Enerji tasarrufu sağlar.
* Atık miktarını azaltarak çöp işlemlerinde kolaylık sağlar.
* Sağladığı kaynak ve enerji tasarrufu sayesinde ülkenin gelişmesine ve ekonomisine katkıda bulunur.
Atık kontrolü, çevreye zarar verecek ya da geri dönüştürülebilecek her türlü atığın; depolanması, taşınması, uzaklaştırılması ve geri dönüşüme kazandırılması ile ilgili yapılan çalışmalardır.
Kullanmadığınız eşyaların tamir ve temizleme dışında hiçbir işleme tabi tutulmadan tekrar kullanılmasına yeniden kullanma denir.