İNDİR
MADDENİN TANECİKLİ YAPISI
ATOM NEDİR?
Maddenin yapı taşına atom denir. Atom çerisinde de daha küçük parçacıklar bulunmaktadır. Atom içerisinde proton, nötron ve elektron bulunur.
Proton ve nötron atomun çekirdeğinde, elektron ise çekirdeğin etrafında hareket etmektedir.
Elektronlar çok geniş bir alanda bulunmaktadırlar.
Bir atomu futbol sahası kadar büyüttüğümüzde çekirdek başlama noktasında bulunan bir böcek kadar olsa, elektronların bulundukları hacim futbol sahası kadardır.
Proton: Çekirdekte bulunur. Yükü + dır.
Nötron: Kütlesi protonun kütlesine eşittir. Çekirdekte bulunur. Yüksüzdür(Nötr).
Elektron: Kütlesi protonun 1/200 kadardır. Çekirdek etrafında çok hızlı hareket eder. Yükü (-) dir.
- Aynı cins her atomun nötron ve elektron sayıları farklı olabilir. Elektronlar alınıp verilebilir, nötron sayıları da değişebilmektedir.
- Bir atomun kimliğini protonlar belirler. Aynı cins atomların proton sayıları da aynıdır.
TARİH BOYUNCA ATOM HAKKINDA GÖRÜŞLER:
1. Democritus (Demokritus)
Yunanlı bir filozoftur. Maddenin taneciklerden oluştuğu fikrini ortaya attı. Bu taneciklere atomos adını verdi. Bu görüşü bilimsel olarak değil varsayım olarak söylemiştir. Democritus’a göre bütün maddelerin atomları aynıdır, atom görülemez ve bölünemez demiştir.
2. John Dalton
Atom hakkında ilk bilimsel açıklamayı yaptı. Dalton’a göre maddenin en küçük yapı birimi atomdur. Atomların içleri dolu berk kürelerden oluşmaktadırlar. Bütün maddelerin farklı cins atomlardan oluştuğunu da söylemiştir.
3. J.J. Thomson
Atomu üzümlü keke benzettiği modelle açıkladı. Atomun dış katmanı pozitif (+) içinde ise negatif (-) yükler bulunmaktadır. Negatif yüklerin hareket etmediğini söylemiştir. Atomun parçalanabileceğini belirtmiştir.
4. Rutherford
Pozitif yüklere proton adını vermiştir. Protonun bulunduğu yeri çekirdek demiştir. Çekirdek etrafında elektronların hareket halinde olduğunu keşfetti. Yaptığı model güneş sistemine benzetmiştir.
5. Niels Bohr
Bohr atom modeline göre elektronlar çekirdek etrafında rastgele dolanmamaktadır. Elektronlar çekirdeğin belirli uzaklıkdaki katmanlarda bulunmaktadır.
6. Modern atom teorisi
Elektronlar çok hızlı hareket ettikleri için, elektronların yerini belirleyemeyiz. Elektronların bulunma ihtimalinin en fazla olduğu yerlere “Elektron Bulutu” denilmektedir.
Elektronların sabit yörüngeleri olduklarından Bohr atom modelinde olduğu gibi katmanlardan bahsetmek zordur. Katman yerine elektron bulutu kullanılmaktadır.
Not: Geçmişten günümüze atom fikrinde birçok değişiklik olmuştur. Atom konusunda herşeyi bildiğimizi söylememiz mümkün değildir. Atom konusunda çalışmalar devam etmektedir.
KARARLI ATOMLAR
Atomlar kararlı yapıda bulunmak isterler. Kararlı yapıda olmaları için 1. katmanda 2, 2. ve 3. katmanda 8 elektron bulundurmalıdırlar.
Helyum 1. katmanda 2 elektronu bulunduğu için kararlı yapıya sahiptir.
Neon ve Argon elementleri de son yörüngelerinde 8 elektron bulundurdukları için kararlı yapıya ulaşmışlardır.
Dublet Kuralı
Atomların elektron dizilimini Helyuma benzetmesine denir.
Oktet Kuralı
2 ve 3 katmanı bulunan elementlerin son katmanındaki elektron sayısını 8 e tamamlamasına oktet kuralı denir.Elektron dizilimini Neon ve Argona benzetmeleridir.
Atomların Kararlı Hale Gelmesi
Dublet ve oktet kuralına uymayan atomlar elektron alarak veya elektron vererek kararlı hale gelirler.
İyon Nedir?
+ veya – yüklü atom yada atom gruplarına iyon denir. İyonlar elektrik yükü ile yüklüdür. (Nötr değildir.)
Atomlar kimyasal bağ yaparken oktet ve dublet kuralına uymak için elektron alı verişi yapar. Bu şekilde iyonlar da oluşur.
Anyon nedir?
Negatif (-) yüklü iyonlara Anyon denir. Anyon oluşabilmesi için atomun elektron alması gerekir. Anyonların elektron sayısı, proton sayısından fazladır.
Katyon nedir?
Pozitif (+) yüklü iyonlara Katyon denir. Katyon oluşabilmesi için atomun elektron vermesi gerekir. Katyonların elektron sayısı, proton sayısından azdır.
Not: Katyonun artı yüklü olduğunu hatırlamak için Katyon kelimesinde t harfinden + olduğu anlarız.
SAF MADDELER
Aynı tür tanecik içeren maddelere saf (arı) madde denir.
Saf maddeler element ve bileşik olmak üzere iki gruba ayrılır.
Element nedir?
1650 yıllarında Robert Boyle (Rabırt Boyl) elementi tanımlamıştır. “Kendinden daha basit maddeye dönüşmeyen ve aynı türdeki taneciklerden oluşan saf madde” olarak tanımlamıştır.
Element: Aynı tür atomlardan oluşan saf maddelerdir. Bakır elementinin içerisinde sadece bakır atomları bulunmaktadır.
Elementin özellikleri
- Saf maddelerdir
- İçerisinde tek cins atom bulunur.
- Fiziksel ve kimyasal yollarla başka maddelere ayrılamaz.
- Sembollerle gösterilir.
- Belirli bir erime, kaynama, yoğunluk değerleri vardır.
- Farklı elementlerin atomları da farklıdır.
- Homojendir
Elementler ve Sembolleri
Her dilde element isimleri farklı isimlendirilmektedir. Element sembolleri ise bütün dünya da aynıdır. Bu sayede bilimsel iletişim kolaylaşır, bileşiklerin formülleri yazılıken kolaylık sağlar. Element sembolleri ise Latince element adlarının ilk harfi, ilk harf kullanılmış ise ilk iki harfi şeklinde kullanılır.
Türkçe’de Hidrojen elementi Latince de Hydro-genes dir. Ancak bütün dillerde Hidrojen elementinin sembolü “H”dir.
Ortaokulda bilinmesi gerekli sıralı ilk 18 Element
| Atom Numarası | Sembol | Türkçe Adı |
| 1 | H | Hidrojen |
| 2 | He | Helyum |
| 3 | Li | Lityum |
| 4 | Be | Berilyum |
| 5 | B | Bor |
| 6 | C | Karbon |
| 7 | N | Azot |
| 8 | O | Oksijen |
| 9 | F | Flor |
| 10 | Ne | Neon |
| 11 | Na | Sodyum |
| 12 | Mg | Magnezyum |
| 13 | Al | Alüminyum |
| 14 | Si | Silisyum |
| 15 | P | Fosfor |
| 16 | S | Kükürt |
| 17 | Cl | Klor |
| 18 | Ar | Argon |
| Adı | Sembol |
| Krom | Cr |
| Demir | Fe |
| Kobalt | Co |
| Nikel | Ni |
| Bakır | Cu |
| Çinko | Zn |
| Kalay | Sn |
| Gümüş | Ag |
| İyot | I |
| Altın | Au |
| Cıva | Hg |
| Kurşun | Pb |
| Potasyum | K |
| Kalsiyum | Ca |
Günlük yaşamda kullanılan elementler ve sembolleri
Bileşik nedir?
Birden fazla elementin bir araya gelerek oluşturdukları yeni ve saf maddeye bileşik denir.
Bileşiklerin özellikleri
- Saf maddedir.
- Homojendir.
- Formüllerle gösterilir.
- Belirli bir erime ve kaynama noktası vardır.
- Elementlerin belirli oranlarda birleşmesi ile oluşur.
- Kimyasal yollarla elementlere ayrılabilir.
- Kendini oluşturan elementlerin özelliklerini göstermezler.
- Yeni fiziksel ve kimyasal özelliklere sahip olur.
- En küçük yapı birimleri moleküllerdir.
- Kimyasal tepkime (değişme) sonucu oluşur.
- Özkütleleri (Yoğunlukları) sabittir.
- En az iki farklı elementten oluşurlar.
- Bileşik oluşurken yeni kimyasal bağlar oluşur.
- Bileşikler iyonik yapıda ve ya molekül yapıda olabilir.
Bileşikler ve Formülleri
Bileşikler yazılırken formül ile gösterilir. Bileşiğin formülü de bütün dünya da aynı şekilde yazılır. Bileşik formülü yazılırken elementin adı ve sağ altına sayısı yazılır. Elementin sayısı bir ise sayı yazılmaz.
Örnek : H2O bileşiğinde iki hidrojen ve bir oksijen atomu vardır, CO2 bileşiğinde ise bir karbon iki oksijen atomu bulunur.
Molekül nedir?
İki ya da daha fazla atomun bir araya gelerek oluşturduğu atom kümelerine molekül denir. Moleküller aynı veya farklı cins atomlardan oluşabilir.
Oksijen molekülü iki tane oksijen atomundan oluşur. Karbondioksit molekülü iki oksijen ve bir karbon atomundan oluşur.
Oksijen Molekülü |  Karbondioksit Molekülü | Ozon Molekülü |
Not: Her molekülde belirli sayıda atom bulunur.
Su, oksijen, karbondioksit gibi atom sayısı fazla olmayan moleküller basit yapılı moleküllerdir. Şeker, protein, yağ ise atom sayısı fazla olduğu için karmaşık yapıdaki moleküllerdir.
Molekül yapılı bileşikler
Bileşikler, farklı cins element atomlarından oluşan moleküllerden oluşmuşsa böyle bileşiklere moleküler yapılı bileşikler denir.
• Bileşikler moleküllerden oluşmuştur.
• Bileşiklerdeki molekülleri oluşturan atomlar arasında kovalent bağ bulunur.
H2O, CO2 , NH3 , SO2 , HCl, şeker molekül yapılı bileşiklerdir.
Molekül yapılı olmayan (İyonik yapılı) bileşikler
Bileşikler, moleküllerden oluşmayıp (atom kümesi), bileşiği oluşturan farklı cins element atomları bir yapı oluşturacak şekilde bir araya gelmişse böyle bileşiklere molekül yapılı olmayan bileşikler denir.
• Bu bileşiklerdeki iyonlar düzenli bir yapı oluştururlar.
• Bileşikler içinde iyonlar sonsuz sayıda arka arkaya dizilmiştir.
• Bileşiği oluşturan iyonlar arasında iyonik bağ bulunur.
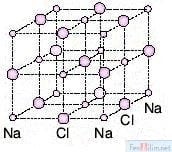
NaCl, CaO gibi bileşikler örnek verilebilir.
KARIŞIMLAR
İki farklı maddenin kendi özelliklerini kaybetmeden bir arada bulunması ile oluşur. Örnek: Tuzlu su. Tuz ve su kendi özelliklerini kaybetmeden bir arada bulunurlar.
Karışımların özellikleri
1. Birden fazla maddenin karışması ile oluşur.
2. Karışımı oluşturanlar kendi özelliklerini kaybetmezler.
3. Maddeler her oranda karışabilir.
4. Fiziksel yolla ayrılırlar.
5. Saf madde değildir.
6. Formül ile yazılmazlar.
7. Belirli bir erime, kaynama noktaları yoktur.
8. Homojen veya heterojen olabilir.
Karışımlar homojen ya da heterojen olabilir.
Homojen Karışımlar (Çözelti)
Karışımı oluşturan maddeler her tarafa eşit olarak dağılmıştır. Tuz-su, Şeker-su, alkol-su homojen karışımdır. Homojen karışımlara çözelti adı da verilmektedir.
Heterojen Karışım (Adi karışım)
Karışımı oluşturan maddeler her tarafa eşit olarak dağılmaz. Heterojen karışımlara adi karışım da denir. Yağ-su, ayran, çamur, kum-su heterojen karışımdır.
Not: Ayran, süt ilk bakışta homojen karışım gibi görünebilir. Bir süre beklendiğinde yoğurt dibe çöker, sütün üzerinde kaymak oluşur. Bu nedenle süt ve ayran heterojen karışımlardır.
Çözeltiyi oluşturan bileşenler
Çözeltiler çözücü ve çözünen maddelerden oluşur.
Çözelti = Çözücü + Çözünen
Şekerli su çözeltisinde, su çözücü şeker ise çözünendir.
Çözünme Olayı Nasıl Oluşur?
Bir maddenin diğer madde içerisinde iyon veya moleküllerine ayrılmasına çözünme denir.
- Çözünmede iyon veya moleküller çözücü içerisine homojen olarak dağılır.
- İyonlarına ayrılarak çözünen maddeler elektrik akımını iletir. Tuzlu suda tuz iyonlarına ayrılarak çözünür.
- Molekül halinde çözünen maddeler elektrik akımını iletmez. Şekerli suda şeker molekül halinde çözünür.
Çözünme hızına etki eden faktörler
1. Sıcaklık
Sıcaklık artırıldığında, çözücü ve çözünen maddelerin taneciklerinin hızı artar. Buda çözünme hızını artırır.
Not: Sıcaklığın artmasıyla katı ve sıvıların çözünme hızı artarken, gazların çözünme hızı azalır.
2. Karıştırma
Karıştırılma veya sallama çözünme hızını artırır. Şeker ve tuz karıştırıldığında daha hızlı çözünür.
Not: Karıştırma, gazların çözünme hızını azaltır.
3. Temas Yüzeyi
Çözünen maddelerin küçültülmesi veya toz haline getirilmesi çözünme hızını artırır. Tanecik boyutu küçültülerek çözücü ile olan temas yüzeyi artırılmış olur.
Çözücü ve Çözünen Miktarına Göre Çözeltiler
Çözeltiler çözünen madde miktarına göre deşik veya seyreltik olarak ikiye ayrılır.
Derişik çözelti: Çözünen madde miktarının çok olmasıdır.
Seyreltik çözelti: Çözünen madde miktarının az olmasıdır.
- Seyreltik çözeltiyi derişik hale getirmek için, çözünen madde miktarı artırılmalı veya çözücü madde buharlaştırılarak uzaklaştırılmalıdır.
- Derişik çözeltiyi seyreltik hale getirmek için çözücü miktarı artırılmalıdır.
KARIŞIMLARIN AYRIŞTIRILMASI
Karışımlar fiziksel yollarla meydana gelmektedir. Bu nedenle fiziksel yollarla birbirinden ayrılırlar.
Karışımların Ayrılma Yöntemleri
1. Buharlaştırma Yöntemi
Karışımlar ısıtılarak içerisindeki sıvılar buharlaştırılır. Karışım içindeki katı madde çökerek ayrışmış olur. Tuz gölünde suyun buharlaşması sonucu tuz dibe çöker. Şeker üretilmesi, pestil yapımı buharlaştırma yöntemi ile yapılır.
2. Yoğunluk farkı ile ayırma
Yoğunlukları farklı olan maddeler karışımların içinden ayrılabilir. Su- yağ karışımı ayırma hunisine alınır, suyun aşağıya çökmesi beklenir. Su musluktan akıtılır, bu şekilde su yağdan ayrılmış olur.
3. Damıtma ile Ayırma
Birbiri ile karışmış olan sıvıların ayrılmasında kullanılan bir yöntemdir. Sıvıların kaynama noktaları farkı ile birbirinden ayrılır. Kaynama noktası düşük olan sıvı önce kaynayarak sıvıdan ayrılacaktır. Başka bir kapta buhar yoğunlaştırılarak sıvılar birbirinden ayrılır.
4. Mıknatısla Ayırma
Mıknatıs demir, nikel, kobalt elementlerini ve bunlardan yapılan maddeleri çekmektedir. Karışım içerisinde demir, nikel ve kobalt varsa mıknatısla ayırım sağlanabilir. Kum içerisinde demir tozları mıknatısla ayrılabilir.
5.Elektriklenme ile Ayırma
Sürtünme ile elektrik yükü kazanan plastik, cam gibi maddeler bazı maddeleri çekerler. Örneğin elektrik yüklü cam çubuk tuz karabiber karışımından karabiberleri çeker. Bu şekilde şeker-kükürt karışımından da kükürt ayrılabilir.
6. Erime Noktası Farkı ile Ayırma
Erime noktaları farklı olan iki katı karışım birbirinden bu şekilde ayrılabilir. Örneğin çinko ve kalay karışımı
7. Tanecik Boyutu Farkı ile Ayırma
Tanecikleri farklı olan maddeler bu şekilde ayrılabilir. Buna eleme yöntemi de denilmektedir. Örneğin kum ile çakıl elenerek ayrılabilir.
8. Özkütle Farkı ile Ayırma
Farklı yoğunluktaki iki maddenin ayrılmasında kullanılır. Örneğin kum ile talaş karışımını ayırmak için su içerisine atarız. Talaş suda yüzerken, kum suda batacaktır.
9. Çözünürlük Farkı ile Ayırma
İki katının ayrılmasından çözünürlüklerinden yaralanılarak ayırma yapılabilir. Bu katılardan birisi sıvıda çözünmesi diğerinin ise çözünmemesi gerekmektedir. Örneğin demir tuzu – tuz karışımını su içerisine attığımızda tuz çözünürken demir tozu çözünmez. Karışım süzüldüğünde demir tozu süzgeçte kalacaktır.
EVSEL ATIKLAR VE GERİ DÖNÜŞÜM
Atık: Kullanım süresi dolan ve yaşadığımız yerden uzaklaşması gereken her türlü maddeye atık denir. Fabrika, ev, okul, iş yerinde atıklar oluşur.
Çöp: Atıkların içerisinde hiçbir şekilde kullanılamayacak olan maddelere çöp denir. Kağıt, cam, plastik, karton, metaller çöp değildir.
Yeniden kullanma: Atık maddelerin hiçbir işlem yapılmadan kullanımıdır. Küçülen eşyaların başkaları tarafından kullanılması, pet şişelerin içerisine tekrar su doldurulması örnek verilebilir.
Geri dönüşüm: Atıkların bazı işlemlerden geçirilerek tekrar kullanılmasıdır. Kağıttan, tekrar kağıt üretme metallerin tekrar kullanılması örnek verilebilir.
EVSEL ATIKLAR
Evsel atık nedir?
Evde kullanımdan düşmüş veya çöp durumunda olan maddelere evsel atık denir. Evde kullanılan atık sular, atık yağlar, kağıt, poşet, pil, şişe, kutu, plastikler, boya atıkları, eski mobilyalar, eskimiş elbiseler, metaller, eskimiş elektronik araçlar, sebze ve meyve atıkları, yemek atıkları evsel atıkdır. Bitki ve hayvan kaynaklı atıklara organik atık denir.
GERİ DÖNÜŞÜM
Geri Dönüşümün Aşamaları
1. Ayırma: Plastik, kağıt, cam ürünler için ayrı ayrı toplama alanlarda ayrıştırılmalıdır.
2. Sınıflandırma: Ayrılan atıklar sınıflandırılmış olur. Sınıflanan malzemeler ayrı ayrı taşınmalıdır.
3. Değerlendirme: Değerlendirilebilen atıklar, fiziksel ve kimyasal işlemlerden geçirilerek yeni ürün oluşur.
Evsel atıkların bazıları geri dönüştürülebilir.
1. Kağıt ürünleri: Kağıt, karton, gazete, dergi, kitap vb.
2. Metal ürünleri: Teneke kutu, alüminyum folyo, içecek kutuları, kablolar, eski mutfak araç gereçleri vb.
3. Plastik ürünleri: Pet şişe, poşet vb.
4. Cam ürünleri: Cam şişe, kavanoz vb.
5. Piller: Pillerin çok büyük kısmı geri dönüştürülür. Akümülatör (Akü), şarjlı piller, bataryalar
Bunlar geri dönüşümle tekrar kullanılabilir.
Geri dönüşümü olmayan evsel atıklar
1. Yağlı kağıt, ıslanmış kağıt, besin atığı bulaşmış kağıtlar
2. Pencere camı, ayna, kristaller, borcam
3. Naylon, köpük, pipet
4. Elektronik cihazlar, ampul, oyuncaklar
5. Bebek bezleri, seramik ürünler
6. İçinde motor yağı, antifriz, benzin konulan şişeler
Geri dönüşümün sağladığı yararlar
- Çevremizin temiz tutulması sağlanır. Çöp kutusuna ve doğaya atılan atıklar azalır. Geleceğe temiz çevre bırakmış oluruz.
- Ekonomiye katkı sağlanır. Petrol ürünlerinin tüketiminin azalması ülke ekonomisine katkı sağlamaktadır.
- Doğal kaynaklar korunmuş olur. Orman ve su kaynakları daha az zarar görür.
- Yeni iş imkanları oluşur. Hurdacılıkla ve kağıt toplayarak geçinen insanlar vardır.
- Enerji tasarrufu sağlanır. Ham madde kullanımı azalacağı için enerji tasarrufu yapılmış olur.
- Atık miktarının azalmasına neden olur. Geri dönüşüm ile oluşan atık miktarı da azaltılmış olmaktadır.
Yeniden Kullanma
Evde kullanılan bazı araçlar ve eşyalar değiştirildiğinde bunlar başkaları tarafından tekrar kullanılabilmektedir. Evdeki kullanılabilir durumdaki mobilyalar, çalışır durumdaki elektronik araçlar başkaları tarafından yeniden kullanılabilir. Evimize yeni aldığımız LCD televizyonun gelmesi ile eski tüplü televizyon başkaları tarafından yeniden kullanılabilir.
Geri Kazanım
Geri kazanım, yeniden kullanma ve geri dönüşüm kavramlarını da kapsar.
Geri kazanım atık ürünlerin ayrıştırılmasıyla yeni ürünler veya enerji üretilmesidir.
Geri kazanım sayesinde çevre kirliliği azalır. Ham madde ihtiyacı azalmış olur.
Bitkisel ve hayvansal atıklar geri dönüştürülemez ancak geri kazanımla gübre veya yakıt üretilebilir.
Otomobil lastiklerinden asfalt, atık yağlardan yakıt üretilmesi de geri kazanımdır.
KİMYA ENDÜSTRİSİ
Kimya nedir?
Kimya, maddenin yapısını, özelliklerini, bileşimini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır.
Kısaca maddenin iç yapısını inceler.
Kimya endüstrisi nedir?
Kimya endüstrisi birçok sektör için gerekli olan ham madde ihtiyacını karşılamaktadır. Otomotiv, deri, çimento, petrol, kağıt, kozmetik, gıda, tekstil, sağlık, boya, ilaç, gübre ve enerji sektörlerinde kullanılmaktadır.
Kimya endüstrisinin önemi nedir?
Kimya endüstrisi yeni ürünlerin ortaya çıkmasını sağlar. Evimizde kullandığımız deterjanlar, yapıştırıcılar, kağıt ürünleri, plastik ürünler, cam malzemeler, boya maddeleri, tekstil ürünleri vb. birçok ürün kimya endüstrisi sayesinde üretilmektedir.
Kimya endüstrisi ülkenin gelişmişlik seviyesinin bir göstergesidir. Kimya endüstrisi diğer sektörlerin gelişmesini sağlamayan önemli bir lokomotiftir.
Ülkemizde kimya endüstrisi
Kimya endüstrisi son yıllarda ülkemiz için çok önemli bir sektör olmuştur. Kimya sektörünün yapmış olduğu ihraç ürünleri ekonomiye katkı sağlamaktır.
Türk plastik sektörü, Avrupa’nın en büyük 2., dünyanın ise en büyük 7. üreticisidir.
Türkiye, dünyanın en büyük 17. otomotiv üreticisidir.
Türkiye, Avrupa’nın en büyük 4. boya üreticisidir.
